川口 綾乃 (KAWAGUCHI, Ayano)
プロフィール
胎生期の哺乳類大脳を舞台に神経幹細胞の運命決定に興味をもって研究を行なっています。

哺乳類の大脳が作られる過程では、神経幹細胞(神経前駆細胞)と呼ばれる未分化な細胞が分裂を繰り返し、発生時期に応じた種々の娘細胞たちを生み出していきます。一つ一つの神経幹細胞がたどる細胞系譜はさまざまです。一方で、脳の発生を全体として眺めてみると、各個体間で実に再現性良く、多様な細胞種からなる複雑な構造物が作り上げられていくことに気づきます。
このような、神経幹細胞とその娘細胞たちの多様な運命はどのような機構で決定されているのでしょうか。
まずは発生の時間軸に沿った変化です。
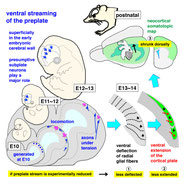
神経幹細胞は発生の時刻が進むに伴い、その分裂パターンを変化させます。また、ニューロン産生の時期であれば、生じる娘細胞がどの層のニューロンになるかも、発生の時刻に対応することが知られています。大きな視点でとらえると、このような発生の時刻に応じた細胞挙動の変化は、神経幹細胞自身の「細胞内」の変化と、細胞が置かれた環境である「場」の変化によるものと解釈されます。
このような幹細胞の「細胞内」の変化の様子は、単一細胞トランスクリプトーム解析などで詳細に記述されるようになってきました(Okamoto et al., 2016;Kawaguchi 2019総説)。一方で、細胞の置かれた「場」の時間軸に沿った変化と幹細胞との関係性は、腑に落ちる程度には明らかとなっていません。例えば、私たちが行った研究からは、神経幹細胞の中にある、発生の時刻を知るための「時計」が正しい時を刻むためには周囲の細胞・細胞が置かれた「場」からの調整が重要であることがわかりました(Okamoto et al., 2016)。しかしその実態は今後の研究課題です。
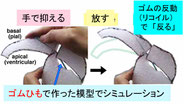
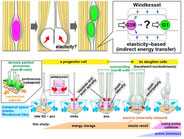
もうすこし小さい視点で、ある一時刻の一つの神経幹細胞に注目してみます。個々の幹細胞には細胞状態のゆらぎがあります。例えば、私たちは最近の研究で、分裂の瞬間の、ある分子の発現レベルの小さな差が、幹細胞の分裂方向の変化を介して、生じる2つの細胞の運命を大きく変えることを示しました(Kawaue et al., 2019)。 この揺らぎの幅も発生時期に応じて変化することが予想されますが、その実態もよくわかっていません。
これらの問いに対して、私たちは分子細胞生物学的なアプローチで研究をおこなっています。まずは、対象を把握する。眺めてみる。いわゆる記述的な情報を集めてみる。そのうえで仮説をたて、仮説を検証するために実験的な操作(主に生体内での遺伝子発現の操作)を行い、変化を捉え、考える。このような研究サイクルを繰り返すことで、少々のことがあっても最終的には同じような脳が作られる、頑強な脳発生の仕組みを理解していきたいと考えています。
参考:
新学術領域「脳構築における発生時計と場の連携」
R1-2年度 公募課題研究
H29-30年度 公募研究課題
Outer radial glia 誕生がもたらす神経幹細胞の場と時間特性の変化
<略歴>
1995 大阪大学医学部医学科 卒業
1995-1998 眼科臨床医 (大阪大学医学部附属病院、国立大阪南病院)
1998-2002 大阪大学大学院 医学系研究科 博士課程
2001-2002 日本学術振興会特別研究員(DC2)
2002-2008 理化学研究所 発生再生科学総合研究センター(CDB)
非対称細胞分裂研究グループ 研究員
2008―現在 名古屋大学大学院医学系研究科 機能形態学講座
細胞生物学分野 准教授

<一緒に研究しませんか?>
2021年度JST創発的研究支援事業に採択されました。
研究課題「上皮構造からの細胞離脱による器官形成制御」
大学院生を募集中です !
興味を持たれた方はお気軽に問い合わせください。
連絡先:川口綾乃
Email: akawa (アットマーク)med.nagoya-u.ac.jp
<原著論文・総説>
*Kawaguchi A.
Neuronal delamination and outer radial glia generation in neocortical development
Front. Cell Dev Biol. 2021,8,623573 (review)
*川口綾乃
細胞離脱の実行役分子Lzts1による大脳形成制御
生化学, 2020, 92(6) 817-821 (日本語総説)
*Hattori Y, Naito Y, Tsugawa Y, Nonaka S, Wake H, Nagasawa T, Kawaguchi A, *Miyata T.
Transient microglial absence assists postmigratory cortical neurons in proper differentiation.
Nature Communications, 2020, 11:1631
Kawaue T, Shitamukai A, Nagasaka A, Tsunekawa Y, Shinoda T, Saito K, Terada R, Bilgic M, Miyata T, Matsuzaki F, *Kawaguchi A.
Lzts1 controls both neuronal delamination and outer radial glial-like cell generation during mammalian cerebral development.
*Kawaguchi A.
Temporal patterning of neocortical progenitor cells: how do they know the right time?
Neurosci Res, 2019,138:3-11 (review)
Saito K, Kawasoe R, Sasaki H, Kawaguchi A, *Miyata T.
Neural progenitor cells undergoing Yap/Tead-mediated enhanced self-renewal from heterotopias more easily in the diencephalon than in the telencephalon.
Neurochem Res, 2018, 43:171-180, DOI:10.1007/s11064-017-2390-x
Delaunay D, Kawaguchi A, *Dehay C, *Matsuzaki F.
Division modes and physical asymmetry in cerebral cortex progenitors.
Current Opinion in Neurobiology, 2017,42:75-83 (review)
Nagasaka A, Shinoda T, Kawaue T, Suzuki M, Nagayama K, Matsumoto T, Ueno N, Kawaguchi A, *Miyata T.
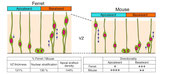
Differences in the mechanical properties of the developing cerebral cortical proliferative zone between mice and ferrets at both the tissue and single-cell levels.
Front.Cell Dev. Biol. 2016, 4:139, DOI:10.3389/fcell.2016.1204857
*Kawaguchi A, and *Matsuzaki F.
Cell cycle–arrested cells know the right time.
Cell Cycle 2016,15:20, 2683-2684, DOI: 10.1080/15384101.2016.1204857 (review)
Okamoto M, Miyata T, Konno D, Ueda R H, Kasukawa T, Hashimoto M, *Matsuzaki F, and *Kawaguchi A.
Cell cycle–independent transitions in temporal identity of mammalian neural progenitor cells.
Nature Communications 2016,7:11349,
*Miyata T, Okamoto M, Shinoda T, Kawaguchi A.
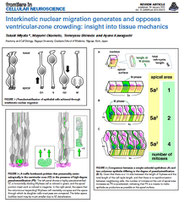
Interkinetic nuclear migration generates and oppses ventricular-zone crowding: insight into tissue mechanics.
Front Cell Neurosci, 2015, 8:473 (review)
Kawaue T, Sagou K, Kiyonari H, Ota K, Okamoto M, Shinoda T, Kawaguchi A, *Miyata T.
Neurogenin2-d4Venus and Gadd45g-d4Venus transgenic mice: Visualizing mitotic and migratory behaviors of cells committed to the neuronal lineage in the developing mammalian brain.
Dev Growth Differ. 2014, 56(4)293-304
Okamoto M, Namba T, Shinoda T, Kondo T, Watanabe T, Inoue Y, Takeuchi K, Enomoto Y, Ota K, Oda K, Wada Y, Sagou K, Saito K,Sakakibara A, Kawaguchi A, Nakajima K, Adachi T, Fujimori T, Ueda M, Hayashi S, Kaibuchi K,*Miyata T.
TAG-1-assisted progenitor elongation streamlines nuclear migration to optimize subapical crowding.
Nature Neuroscience, 2013, 16(11):1556-66
*Miyata T, Ono Y, Okamoto M, Masaoka M, Sakakibara A, Kawaguchi A, Hashimoto M, Ogawa M.
Migration, early axonogenesis, and Reelin-dependent layer-forming behavior of early/posterior-born Purkinje cells in the developing mouse lateral cerebellum.
Neural Development , 2010, 5, 23(online).
Kato TM, Kawaguchi A, Kosodo Y, Niwa H, *Matsuzaki F.
Lunatic fringe potentiates Notch signaling in the developing brain.
Mol Cell Neurosci. 45, 12-25, 2010
Miyata T, Kawaguchi D, Kawaguchi A, *Gotoh Y.
Mechanisms that regulate the number of neurons during mouse neocortical development.
Current Opinion in Neurobiology 20, 22-28, 2010 (review)
*Kawaguchi A, Ikawa T, Kasukawa T, Ueda R.H, Kurimoto K, Saitou M, *Matsuzaki F.
Single-cell gene profiling defines differential progenitor subclasses in mammalian neurogenesis.
Development 135,3113-3124, 2008 , CDBニュース
*Kawaguchi A, Ogawa M, Saito K, Matsuzaki F, Okano H, Miyata T.
Differential expression of Pax6 and Ngn2 between pair-generated cortical neurons.
J Neurosci Res, 78, 784-795, 2004
*Miyata T, Kawaguchi A, Saito K, Kawano M, Muto T, Ogawa M.
Asymmetric production of surface-dividing and non-surface-dividing cortical progenitor cells.
Development 13, 3133-3145, 2004
Saito K, Kawaguchi A, Kashiwagi S, Yasugi S, Ogawa M, *Miyata T.
Morphological asymmetry in dividing retinal progenitor cells.
Dev Growth Differ 45, 219-229, 2003
*Miyata, T., Kawaguchi A, Saito, K., Kuramochi, H., and Ogawa, M.
Visualization of cell cycling by an improvement in slice culture methods.
J Neurosci Res 69 (6), 861-868, 2002
Murayama, A., Matsuzaki, Y., Kawaguchi A,, Shimazaki, T., and *Okano, H.
Flow cytometric analysis of neural stem cells in the developing and adult mouse brain.
J Neurosci Res 69 (6), 837-847, 2002
*Miyata, T., Kawaguchi A,, Okano, H., and Ogawa, M.
Asymmetric inheritance of radial glial fibers by cortical neurons.
Neuron 31 (5), 727-741, 2001
Sawamoto, K., Yamamoto, A., Kawaguchi A,, Yamaguchi, M., Mori, K., Goldman, S.A. and *Okano, H.
Direct isolation of committed neuronal progenitor cells from transgenic mice co-expressing spectrally-distinct fluorescent proteins regulated by stage-specific neural promoters.
J Neurosci Res 65 (3), 220-227, 2001
Kawaguchi A, Miyata, T., Sawamoto, K., Takashita, N., Murayama, A., Akamatsu, W., Ogawa, M., Okabe, M., Tano, Y., Goldman, S.A., and *Okano, H.
Nestin-EGFP mice: visualization of the self-renewal and multipotency of CNS stem cells.
Mol Cell Neurosci 17 (2), 259-273, 2001
Roy N., Benraiss A., Wang S., Fraser R., Goodman R., Couldwell W., Nedergaard M., Kawaguchi A, Okano H., *Goldman S.A.
Promoter-targeted selection and isolation of neural progenitor cells from the adult human ventricular zone.
J Neurosci Res 59 (3), 321-331, 2000
Roy NS, Wang S, Jiang L, Kang J, Benraiss A, Harrison-Restelli C, Fraser RA, Couldwell WT, Kawaguchi A, Okano H, Nedergaard M, *Goldman SA.
In vitro neurogenesis by progenitor cells isolated from the adult human hippocampus.
Nature Medicine 6 (3), 271-277, 2000